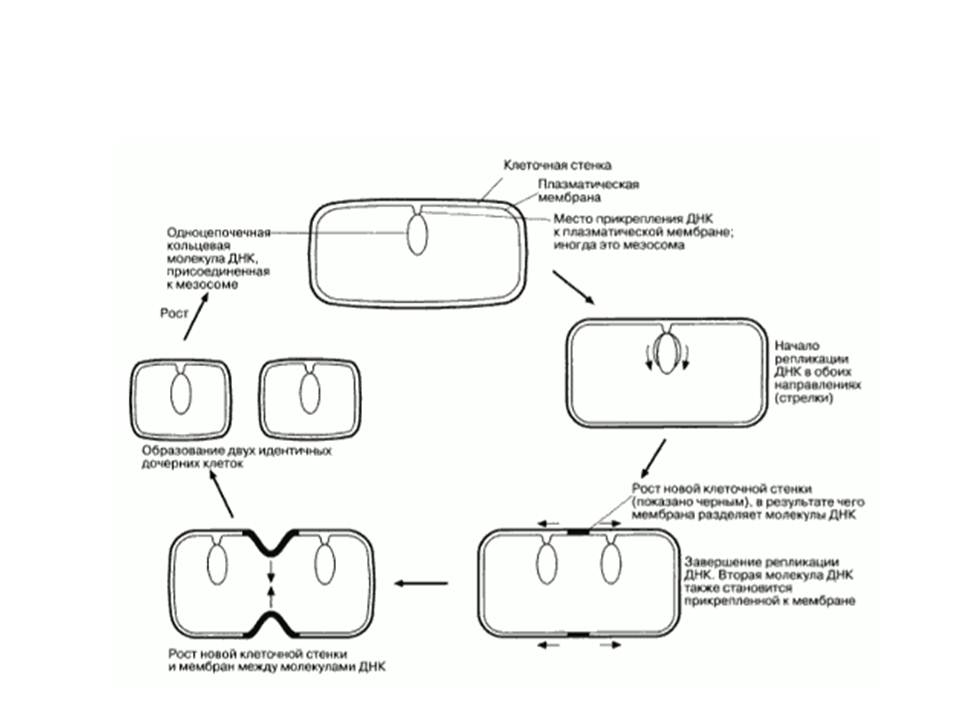
Культивирование и рост микроорганизмов
Питательные среды
Требования, предъявляемые к средам
- быть питательными, т.е. содержать в легко усвояемом виде все вещества, необходимые для удовлетворения пищевых и энергетических потребностей. При культивировании ряда микроорганизмов в среды вносят факторы роста - витамины, некоторые аминокислоты, которые клетка не может синтезировать.
- иметь оптимальную концентрацию водородных ионов - pH, т.к. только при оптимальной реакции среды, влияющей на проницаемость оболочки, микроорганизмы могут усваивать питательные вещества.
Для большинства патогенных бактерий оптимальна слабощелочная среда (pH 7,2-7,4). Исключение составляют холерный вибрион - его оптимум находится в щелочной зоне (pH 8,5-9,0) и возбудитель туберкулёза, нуждающийся в слабокислой реакции (pH 6,2-6,8).
Чтобы во время роста микроорганизмов кислые или щелочные продукты их жизнедеятельности не изменили pH, среды́ должны обладать буферностью, т.е. содержать вещества, нейтрализующие продукты обмена.
- быть изотоничными для микробной клетки; т.е. осмотическое давление в среде должно быть таким же, как внутри клетки. Для большинства микроорганизмов оптимальная среда, соответствующая 0,5% раствору натрия хлорида.
- быть стерильными, т.к. посторонние микробы препятствуют росту изучаемого микроба, определению его свойств и изменяют свойства среды.
- плотные среды́ должны быть влажными и иметь оптимальную для микроорганизмов консистенцию.
- обладать определённым окислительно - восстановительным потенциалом, т.е. соотношением веществ, отдающих и принимающих электроны, выражаемым индексом RH2. Например, анаэробы размножаются при RH2, не выше 5, а аэробы - при RH2 не ниже 10.
- быть по возможности унифицированным, т.е. содержать постоянное количество отдельных ингредиентов.
Желательно, чтобы среды́ были прозрачными - удобнее следить за ростом культур, легче заметить загрязнение среды посторонними микроорганизмами.

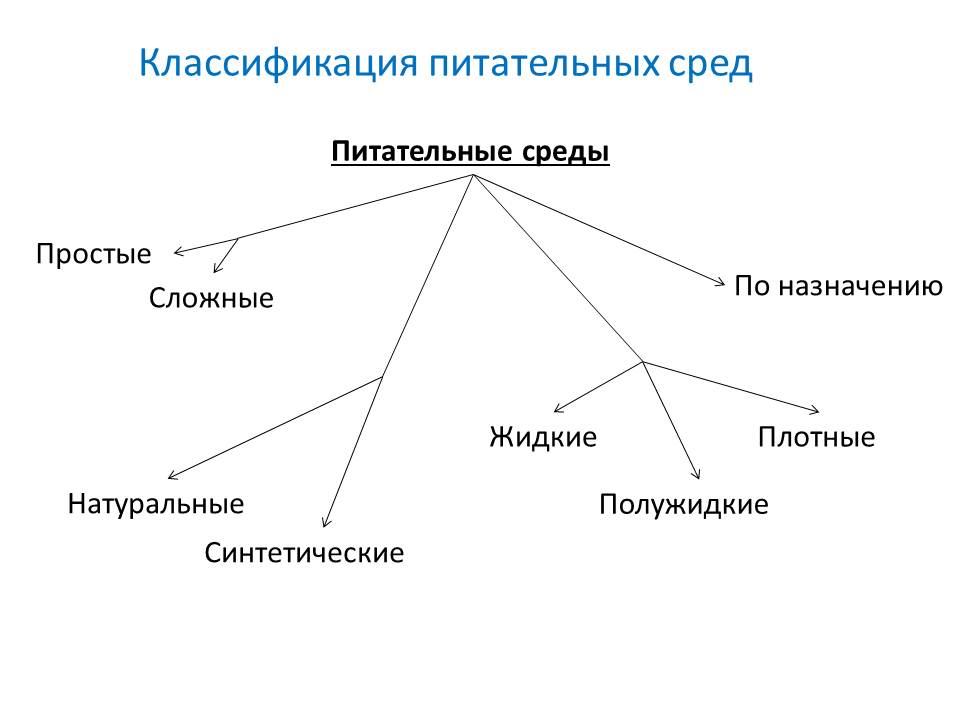
Классификация
- По исходным компонентам:
- натуральные среды - готовят из продуктов животного и растительного происхождения(мясо, костная и рыбная мука, кормовые дрожжи, сгустки крови и др.)
- синтетические среды - готовят из определённых химически чистых органических и неорганических соединений, взятых в точно указанных концентрациях и растворённых в дважды дистиллированной воде.
- По консистенции( степени плотности):
- жидкие
- полужидкие
- плотные
Плотные и полужидкие среды готовят из жидких, к которым прибавляют агар-агар или желатин. Кроме того, в качестве плотных сред применяют свёрнутую сыворотку крови, свёрнутые яйца, картофель, среды с селикагелем.Некоторые микроорганизмы используют желатин как питательное вещество - при их росте среда разжижается.
- По составу:
- простые: мясопептонный бульон(МПБ), мясопептонный агар(МПА), , питательный желатин,
- сложные - готовят прибавляя к простым средам кровь, сыворотку, углеводы и другие вещества.
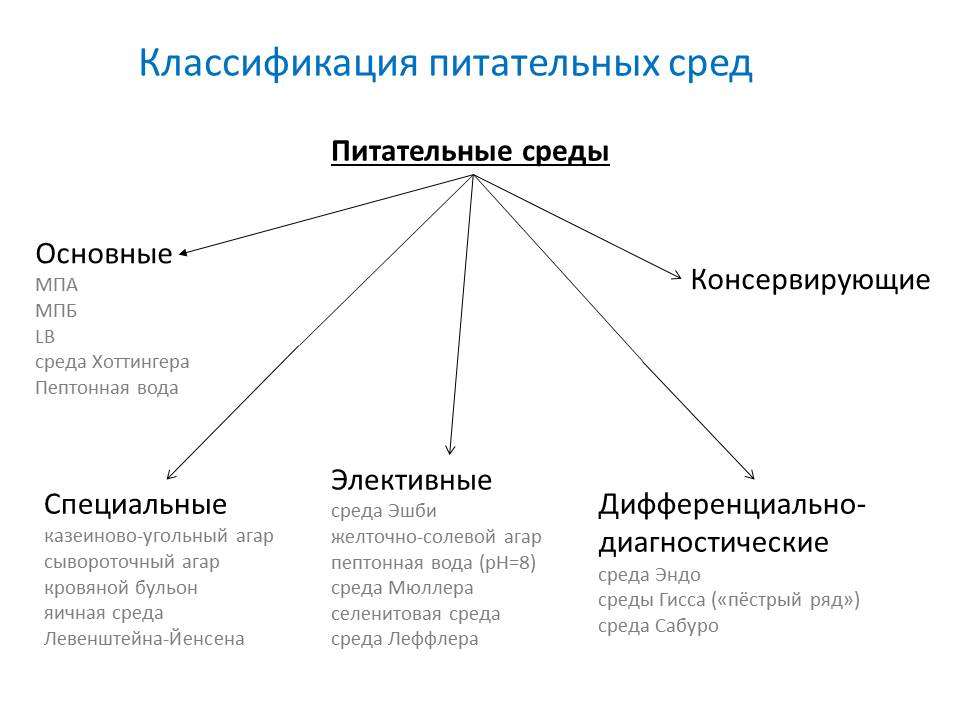
- По назначению:
- основные - служат для культивирования большинства патогенных микробов. МПБ, МПА, бульон и агар Хоттингера, пептонная вода.
- специальные - служат для выделения и выращивания микроорганизмов, не растущих на простых средах.
- элективные( избирательные) - служат для выделения определённого вида микробов, росту которых они благоприятствуют, задерживая или подавляя рост сопутствующих микроорганизмов. Среды становятся элективными при добавлении к ним определённых антибиотиков, солей, изменения pH. Жидкие элективные среды называют средами накопления.
- дифференциально-диагностические - позволяют отличить один вид микробов от другого по ферментативной активности.
- консервирующие - предназначены для первичного посева и транспортировки исследуемого материала.
Простые
- мясо-пептонный бульон (МПБ) — жидкая среда
- мясо-пептонный агар (МПА) — плотная среда
Специальные
Специальные методы характеризуются добавлением специфического компонента или заменой основы.
- казеиново-угольный агар
- сывороточный агар
- кровяной бульон
- яичная среда Левенштейна-Йенсена
Элективные
Элективные методы характеризуются получением роста только интересующего микроорганизма.
- Среда Эшби – для азотфиксаторов
- желточно-солевой агар (ЖСА) — для стафилококка
- пептонная вода (1 %,pH=8) — для холерного вибриона
- среда Мюллера — для сальмонелл
- селенитовая среда — для сальмонелл
- среда Леффлера — эффективна для коринебактерий дифтерии
Дифференциально-диагностические
Позволяют произвести идентификацию отдельных типов, видов и групп бактерий.
- среды Гисса («пёстрый ряд»)
- среда Эндо – определение вирулентных энтеробактерий
- среда Сабуро — с добавлением антибиотика

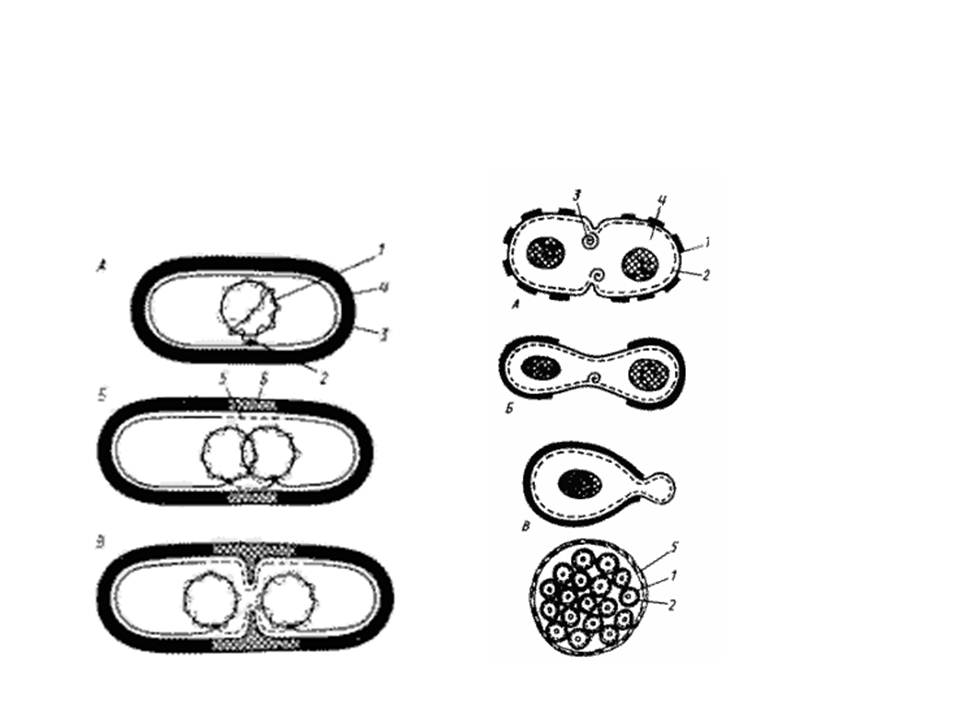

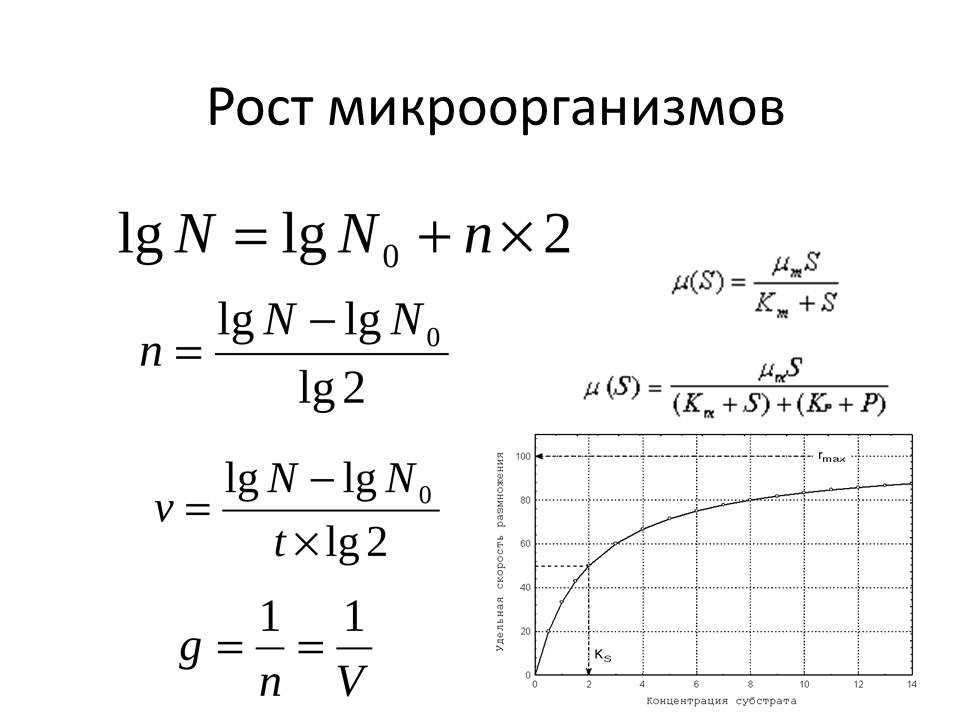
Синхронные культуры
Синхронные культуры – это бактериальные культуры или популяции, в которой все клетки находятся на одинаковой стадии клеточного цикла. В естественных культурах – периодических и проточных – такого явления не наблюдается. Даже в экспоненциальной фазе роста в культуре содержатся неделящиеся и находящиеся на разных стадиях деления клетки. Синхронное деление клеток вызывают искусственно, воздействуя на культуру различными факторами, например, пониженной или повышенной температурой. Считается, что неблагоприятные температуры больше сказываются на развитии делящихся клеток, более чувствительных к действию различных факторов. В результате происходит торможение развития. За это время к делению подготовятся другие клетки культуры. Следующее за ним воздействие оптимальной температуры постепенно вызывает синхронное деление клеток. Для получения синхронных культур используют метод вынужденного голодания. Клетки помещают на неполноценную среду, культивируют, затем переносят на полноценную. У фотосинтезирующих бактерий синхронные культуры получают чередованием световых и темновых режимов культивирования. Также используют механические методы: пропускание культуры через специальные фильтры (отбор клеток одинакового размера) и центрифугирование (клетки, находящиеся в начале цикла деления, более мелкие и оседают медленнее).
Синхронные культуры используют для изучения синтеза отдельных клеточных компонентов в процессе деления клетки.
Непрерывные культуры
В 50-е годы 20 века был разработан метод непрерывного культивирования микроорганизмов (метод проточных культур). Сущность метода состоит в том, что в культиватор, где производится выращивание бактерий, все время поступает свежая питательная среда и одновременно с такой же скоростью выводится культуральная жидкость. В результате для микроорганизмов создаются неизменные условия в отношении наличия питательных веществ и фактически отсутствия продуктов обмена. Регулируя скорость проточной среды, можно управлять развитием бактериальной популяции, например, задержать культуру в логарифмической фазе роста на любое длительное время.
Непрерывное культивирование осуществляется в специальных приборах – хемостатах и турбидостатах. В хемостатах рост культуры контролируется концентрацией субстрата. Поддерживая постоянной концентрацию одного из необходимых субстратов (источник азота или углерода) путем регулирования скорости протока среды, можно стабилизировать скорость роста культуры и плотность популяции. При больших скоростях протока среды рост культуры более интенсивный и приближается к максимальному; при меньших – более медленный вследствие ограниченного поступления субстрата. Однако увеличение скорости протока с целью устранения ограничения роста культуры субстратом приводит к вымыванию культуры, снижению плотности популяции.
В отличие от хемостатов принцип работы турбидостата основан на регулировании скорости протока среды плотностью популяции. В турбидостате плотность популяции контролируется с помощью фотоэлемента, соединенного с реле, которое регулирует подачу среды. Как только плотность популяции достигнет заданного уровня, реле срабатывает и в культиватор начинает поступать свежая среда. В результате концентрация клеток уменьшается до определенного уровня, после чего автоматически отключается подача среды. В турбидостате достигается максимальная скорость роста культуры при большей плотности популяции и большей точности регулирования поступления среды.
Проточное культивирование микроорганизмов используется в изучении физиологии микроорганизмов, т.к. позволяет их культивировать в контролируемых условиях. Кроме того, этот метод нашел широкое применение в микробиологической промышленности, т.к. дает возможность управлять биосинтетическими процессами микроорганизмов.

Выделение чистых культур микроорганизмов
Чистой культурой называют такую культуру, которая содержит микроорганизмы одного вида. Выделение чистых культур бактерий - обязательный этап бактериологического исследования в лабораторной диагностике инфекционных болезней, в изучении микробной загрязненности различных объектов окружающей среды, и, в целом, при любой работе с микроорганизмами. Исследуемый материал (гной, мокрота, фекалии, кровь и другой материал от больных; вода, почва, воздух, пищевые продукты, трупы животных и человека, переносчики) обычно содержит ассоциации микробов.
Выделение чистой культуры позволяет изучить морфологические, культуральные , биохимические, антигенные и другие признаки, по совокупности которых определяется видовая и типовая принадлежность возбудителя, то есть производится его идентификация.
Для выделения чистых культур микроорганизмов используют методы, которые можно разделить на несколько групп.
- Метод Пастера - последовательное разведение исследуемого материала в жидкой питательной среде до концентрации одной клетки в объеме (имеет историческое значение).
- Метод Коха («пластинчатые разводки») - последовательное разведение исследуемого материала в расплавленном агаре (температура 48-50 ° С), с последующим разливом в чашки Петри, где агар застывает. Высевы делают, как правило, из трех-четырех последних разведений, где бактерий становится мало и, в дальнейшем, при росте на чашках Петри появляются изолированные колонии, образующиеся из одной исходной материнской клетки. Из изолированных колоний в глубине агара получают чистую культуру бактерий пересевом на свежие среды.
- Метод Шукевича - применяется для получения чистой культуры протея и других микроорганизмов обладающих «ползущим» ростом. Посев исследуемого материала производят в конденсационную воду у основания скошенного агара . Подвижные микробы (протей) способны подниматься вверх по скошенному агару , неподвижные формы остаются расти внизу на месте посева. Пересевая верхние края культуры можно получить чистую культуру.
- Метод Дригальского - широко применяется в бактериологической практике, при этом исследуемый материал разводят в пробирке стерильным физиологическим раствором или бульоном. Одну каплю материала вносят в первую чашку и стерильным стеклянным шпателем распределяют по поверхности среды. Затем этим же шпателем (не прожигая его в пламени горелки) делают такой же посев во второй и третьей чашках. С каждым посевом бактерий на шпателе остается все меньше и меньше и, при посеве на третью чашку, бактерии будут распределяться по поверхности питательной среды отдельно друг от друга. Через 1-7 сут выдерживания чашек в термостате (в зависимости от скорости роста микроорганизмов) на третьей чашке каждая бактерия дает клон клеток, образуя изолированную колонию, которую пересевают на скошенный агар с целью накопления чистой культуры.
- Метод Вейнберга . Особые трудности возникают при выделении чистых культур облигатных анаэробов. Если контакт с молекулярным кислородом не вызывает сразу же гибели клеток, то посев производят по методу Дригальского , но после этого чашки сразу помещают в анаэростат . Однако чаще пользуются методом разведения. Сущность его заключается в том, что разведения исследуемого материала проводят в расплавленной и охлажденной до 45-50 ° С агаризированной питательной среде. Делают 6-10 последовательных разведений, затем среду в пробирках быстро охлаждают и заливают поверхность слоем смеси парафина и вазелинового масла, чтобы помешать проникновению воздуха в толщу питательной среды. Иногда питательную среду после посева и перемешивания переносят в стерильные трубки Бурри или капиллярные пипетки Пастера, концы которых запаивают. При удачном разведении в пробирках, трубках Бурри , пипетках Пастера вырастают изолированные колонии анаэробов. Чтобы изолированные колонии хорошо были видны, используют осветленные питательные среды. Для извлечения изолированных колоний анаэробов, пробирку слегка нагревают, вращая ее над пламенем, при этом агар , прилегающий к стенкам, плавится и содержимое пробирки в виде агарового столбика выскальзывает в стерильную чашку Петри. Столбик агара разрезают стерильным пинцетом и извлекают колонии петлей. Извлеченные колонии помещают в жидкую среду, благоприятную для развития выделяемых микроорганизмов (например, среду Китта-Тароцци ). Агаризированную среду из трубки Бурри выдувают, пропуская газ через ватную пробку.
- Метод Хангейта - когда хотят получить изолированные колонии бактерий с особенно высокой чувствительностью к кислороду (ст рогие аэробы) используют метод вращающихся пробирок Хангейта . Для этого расплавленную агаризированную среду засевают бактериями при постоянном токе через пробирку инертного газа, освобожденного от примеси кислорода. Затем пробирку закрывают резиновой пробкой и помещают горизонтально в зажим, вращающий пробирку, среда при этом равномерно распределяется по стенкам пробирки и застывает тонким слоем. Применение тонкого слоя в пробирке, заполненной газовой смесью, позволяет получить изолированные колонии, хорошо видимые невооруженным глазом.
- Выделение отдельных клеток с помощью микроманипулятора . Микроманипулятор - прибор, позволяющий с помощью специальной микропипетки или микропетли извлекать одну клетку из суспензии. Эту операцию контролируют под микроскопом. На предметном столике микроскопа устанавливают влажную камеру, в которую помещают препарат «висячая капля». В держателях операционных штативов закрепляют микропипетки ( микропетли ), перемещение которых в поле зрения микроскопа осуществляется с микронной точностью благодаря системе винтов и рычагов. Исследователь, глядя в микроскоп, извлекает отдельные клетки микропипетками и переносит их в пробирки со стерильной жидкой средой для получения клона клеток.
